陈薇团队康希诺疫苗等2款国产新冠疫苗获批上市


独家抢先看
据国家药监局网站消息,2月25日,国家药品监督管理局附条件批准康希诺生物股份公司重组新型冠状病毒疫苗(5型腺病毒载体)注册申请。该疫苗是首家获批的国产腺病毒载体新冠病毒疫苗,适用于预防由新型冠状病毒感染引起的疾病(COVID-19)。
同日,国家药品监督管理局附条件批准国药集团中国生物武汉生物制品研究所有限责任公司的新型冠状病毒灭活疫苗(Vero细胞)注册申请。该疫苗适用于预防由新型冠状病毒感染引起的疾病(COVID-19)。
国家药监局根据《疫苗管理法》《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准上市注册申请。国家药监局要求该疫苗上市许可持有人继续开展相关研究工作,完成附条件的要求,及时提交后续研究结果。
相关报道
康希诺与陈薇院士团队新冠疫苗获批上市
刚刚,据药监局官网消息,国家药监局附条件批准 2 款国产新冠疫苗上市。
两款疫苗分别是康希诺生物与陈薇院士团队共同研发的重组新型冠状病毒疫苗(5 型腺病毒载体)Ad5-nCoV、国药集团中国生物武汉生物制品研究所有限责任公司的新型冠状病毒灭活疫苗(Vero 细胞)。
其中,康希诺新冠疫苗是我国首个被批准上市的腺病毒载体新冠疫苗,在此之前,康希诺新冠疫苗已经获得了巴基斯坦和墨西哥的紧急使用授权。
据康希诺生物官网披露的 III 期临床试验数据,在单针接种疫苗 28 天后,疫苗对所有症状的总体保护效力为 65.28%;在单针接种疫苗 14 天后,疫苗对所有症状的总体保护效力为 68.83%。
而对于重症的保护效力分别为:单针接种 28 天后 90.07%;单针接种 14 天后 95.47%。
康希诺:全球第一个进入临床的新冠疫苗
2020 年 3 月,康希诺新冠疫苗在武汉开展 I 期临床试验,成为全球首个进入临床研究阶段的新冠候选疫苗。
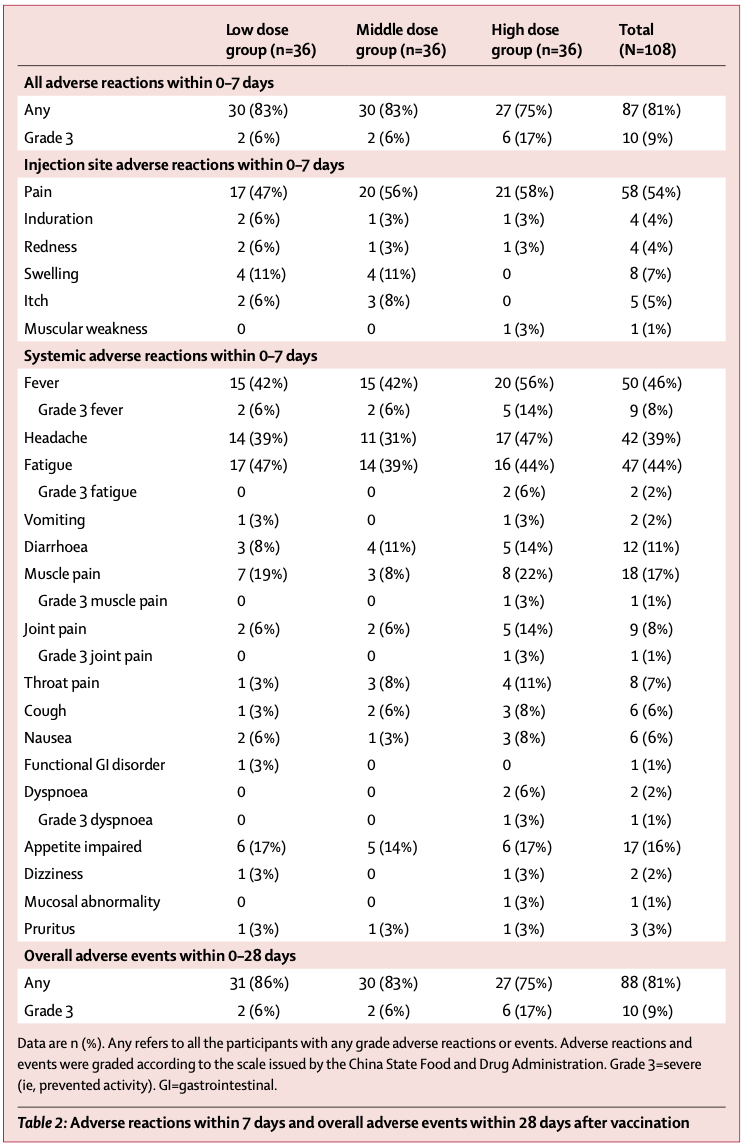
I 期试验未设置对照组,共纳入了 108 人。其中低剂量组、中剂量组和高剂量组各纳入了 36 人。
在低剂量组中,83% 的志愿者在接种后七天内出现了不良反应,而在中剂量和高剂量组中,这个比例则分别是 83% 和 75%。
54% 的志愿者反映了注射部位疼痛,这也是 I 期试验中最常见的不良反应。其他常见的全身性不良反应包括了发热(46%)、疲劳(44%)、头痛(39%)、肌肉痛(17%)等。各剂量组之间的不良反应发生率未展现出统计学差异。
高剂量组的 1 名志愿者在接种疫苗后出现高热、疲累、呼吸困难、肌肉疼痛的异常反应,疫苗团队经过研究,认为这起不良反应和 Ad5 载体引起的病毒血症相关,此前 Ad5 载体的埃博拉疫苗也曾出现类似不良反应。
除此之外,大部分的反应均为轻中度的,且均在接种后的 24 小时内出现,并在 48 小时内消退。在 28 天的试验周期中,没有志愿者出现严重的不良反应。
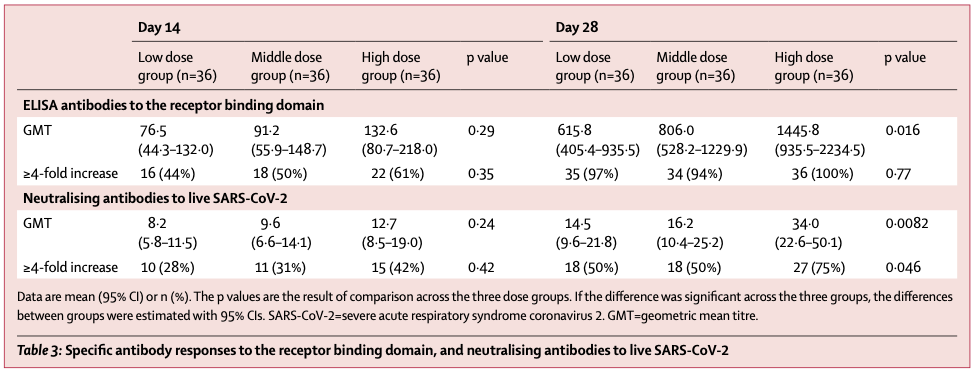
在第 14、28 天的 ELISA 抗体和中和性抗体检测中,各剂量组抗体滴度几何平均值均为阳性。而且,三个剂量组的抗体都在第 28 日达到峰值。高剂量组的抗体滴度较中、低剂量组更高,并具有统计学意义。T 细胞的免疫应答在注射后的第 14 天到达峰值。
但 I 期试验结果提示,年龄在 45~60 岁的志愿者,较更年轻的志愿者相比,血清中和抗体阳转率较低。
2020 年 4 月,疫苗的 II 期临床试验于武汉启动。
由于在此前的 I 期临床试验中,高剂量组的 3 级不良反应率明显高于中、低两个剂量组,并出现了一例异常反应,故 II 期临床试验中只使用低剂量和中剂量疫苗。
II 期试验中,共有 508 名志愿者入组,其中 253 人入中剂量疫苗组,129 人入低剂量组,126 人入对照组。
在注射疫苗后,72% 的中剂量组和 74% 的低剂量组志愿者出现不良反应,其中,中剂量组有 24 人(9%)有较为强烈的不良反应,低剂量组也有 1 人(1%)出现。此外,48% 的安慰剂组志愿者也出现了不良反应。和 I 期试验中的情况类似,这些不良反应都在出现后的 48 小时内自行消退。
整个 II 期临床试验也跟 I 期试验一样,没有出现严重的不良反应。
II 期临床试验数据表明,中剂量组 96% 和低剂量组 91% 的志愿者在接种疫苗 28 天后,能够产生对新冠病毒的体液免疫反应。且约 90% 的志愿者诱导了细胞免疫反应。
II 期试验还再一次表明了,年龄是影响疫苗作用的一个关键因素:55 岁及以上的志愿者免疫后产生抗体的水平不如较年轻的志愿者。不过,年轻的志愿者接种后出现发热反应的概率更大一些。
腺病毒载体和预存免疫
在国内研发进展处于前列的几款新冠候选疫苗中,康希诺的 Ad5-nCoV 是唯一采用单针免疫程序的新冠疫苗。单剂接种可以快速实现免疫保护,缩短接种周期。同时,在相同的疫苗产能下,单次免疫的疫苗和需要两剂接种的疫苗相比,可覆盖人群多出 1 倍。
由于该款疫苗使用腺病毒载体技术路线,与相同技术路线开发的重组埃博拉病毒病疫苗(腺病毒载体)一样,可于 2°C 至 8°C 之间稳定保存,更易于正常运输及存储,疫苗可及性更高。
腺病毒是一种无包膜的双链 DNA 病毒,人感染后多表现为自限性疾病。过去的研究发现:携带保护性抗原基因的腺病毒载体,能够刺激人体产生强烈的抗原特异性体液和细胞免疫应答。
康希诺新冠疫苗以复制缺陷型人 5 型腺病毒(Ad5)为载体,采用基因工程方法构建,可表达新型冠状病毒 S 抗原。
在此之前,5 型腺病毒载体已被用于埃博拉疫苗、HIV 疫苗、流感疫苗的研发,均有一定的进展。2017 年 10 月,同样是康希诺公司开发的 5 型腺病毒载体埃博拉病毒病疫苗 Ad5-EBOV,在中国有条件获批上市,该产品目前被用作国家储备。
不过,腺病毒载体疫苗的实际应用仍存在挑战。
Ad5 在自然界中广泛存在,大多数人都曾被自然感染而对 Ad5 具有预先存在的免疫力,这种现象被称为预存免疫。
以我国为例,Ad5 腺病毒的抗体的血清流行率约为 60%~82%。而在康希诺新冠疫苗的 I 期试验中,就有志愿者体内存在「预存抗体」。
这些预存抗体在一定程度上也影响了 Ad5 载体疫苗的免疫原性,也就是影响疫苗产生保护性新冠病毒抗体的能力。
其他腺病毒载体新冠疫苗
同样使用了腺病毒载体的新冠疫苗中,强生(Ad26.COV2.S)、牛津大学/阿斯利康(AZD1222)和俄罗斯 Gamaleya 研究中心(卫星 V)也已公布了临床试验数据。
1 月 29 日,强生 Ad26 腺病毒载体新冠疫苗公布 III 期临床试验中期分析数据。共有 43783 名受试者入组,中期分析中 468 人感染新冠。
单剂接种 28 天后,中度至重度新冠肺炎的保护力在美国为 72%,在拉丁美洲为 66%,在南非为 57%(其中 95% 为 B.1.351 突变株)。单剂接种 28 天后,重症病例保护力为 85%。
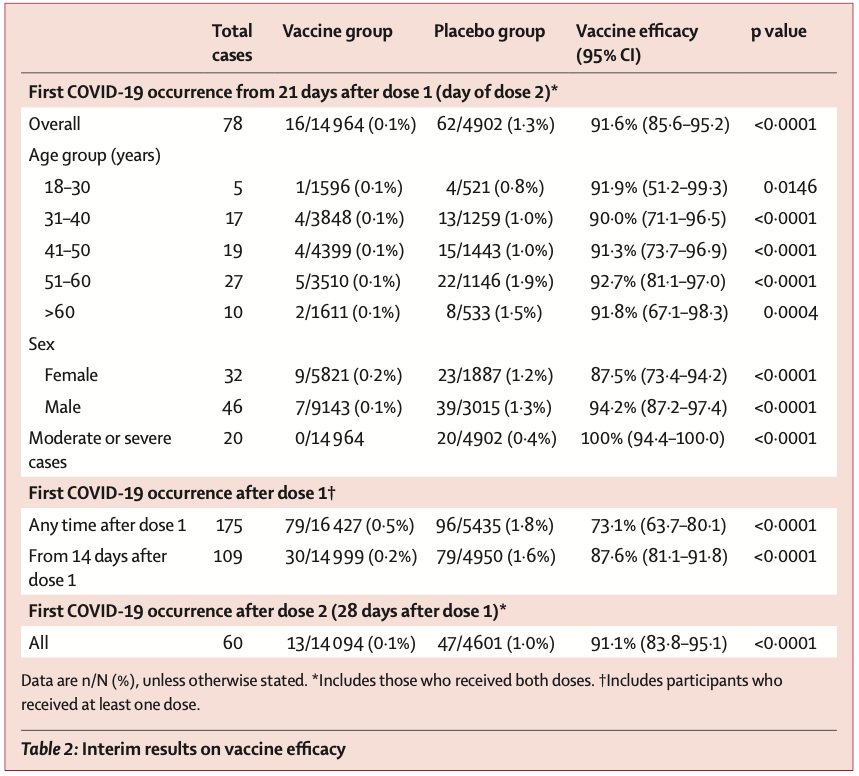
2 月 2 日,俄罗斯新冠疫苗 Sputnik V(卫星 V)在 Lancet 上发表 III 期临床试验结果,卫星 V 疫苗保护力为 91.6%(95%CI:85.6~95.2)。
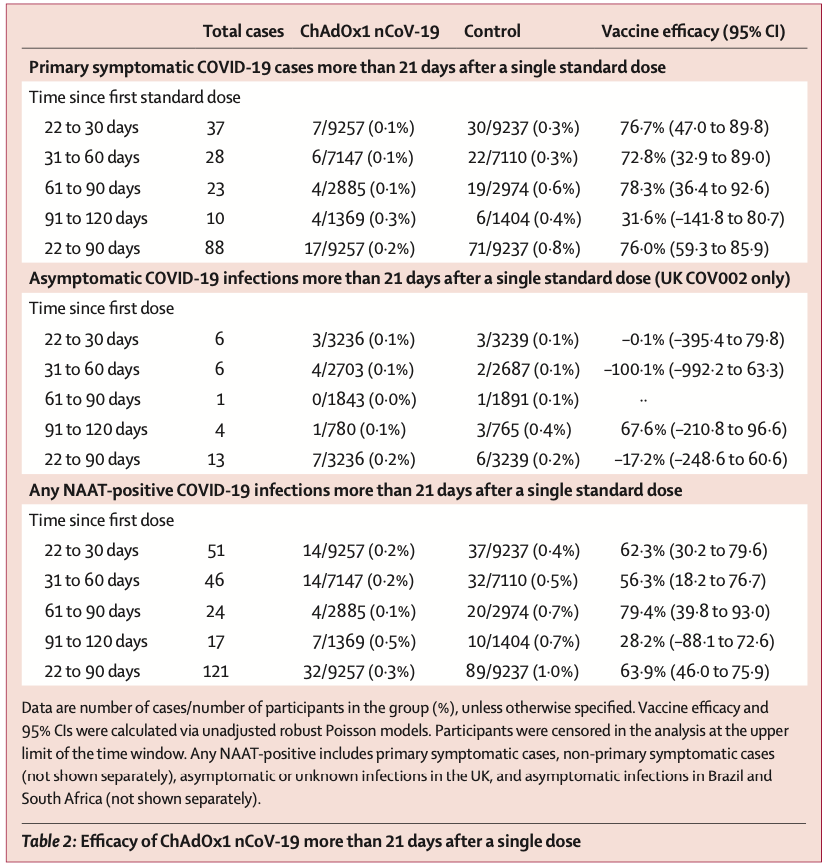
2 月 19 日,阿斯利康和牛津大学联合研发的新冠疫苗 AZD1222 在 Lancet 上发表 III 期临床试验结果。
结果显示,在两次标准剂量接种后的 6 天内,疫苗保护力为 54.9%(95%CI:32.7~69.7)。第一次接种疫苗后 22~90 天,疫苗的保护力为 76%(95%CI:59~86),接种者抗体水平稳定。而在两次标准剂量接种 12 周后,疫苗保护力为 82.4%(95%CI:62.7~91.7)。
如何克服预存免疫的问题,一直是腺病毒载体疫苗的关注重点。据 ClinicalTrials.gov 消息,牛津/阿斯利康与俄罗斯卫星 V 已注册临床试验,评估两种疫苗混合接种的安全性和免疫原性,以此来规避第一针疫苗带来的 Ad 载体预存抗体对第二针疫苗效果的影响。
国药中生武汉:又一款灭活疫苗
在新冠疫苗研发计划中,国药集团中国生物旗下的武汉生物制品研究所和北京生物制品研究所两个单位,在灭活疫苗路线上并行研究。
2020 年底,我国获批上市的首款新冠疫苗来自北京生物制品研究所,而这次,武汉生物制品研究所也带来了 III 期临床试验数据。
据官网披露,国药中生武汉生物制品研究所于 2020 年 7 月 16 日起,在阿联酋等多个国家开展了多中心、随机、双盲、安慰剂平行对照设计的新冠灭活疫苗 Ⅲ 期临床试验 。
Ⅲ 期临床试验中期数据分析显示:两针免疫程序接种后,疫苗接种者均产生高滴度抗体,中和抗体阳转率为 99.06%,疫苗针对新冠肺炎的保护效力为 72.51%,达到国家药监局相关标准要求。
2021 年 2 月 21 日,和康希诺同天提交附条件上市申请,并在今天同日获得上市批准。
“特别声明:以上作品内容(包括在内的视频、图片或音频)为凤凰网旗下自媒体平台“大风号”用户上传并发布,本平台仅提供信息存储空间服务。
Notice: The content above (including the videos, pictures and audios if any) is uploaded and posted by the user of Dafeng Hao, which is a social media platform and merely provides information storage space services.”