在2021全国疫苗与健康大会上,高福院士呼吁“大家要关注mRNA疫苗,它给人类提供了无限的思考”。那么mRNA疫苗究竟是什么呢?它是怎么被发现的,有什么应用价值?它能否抵抗全球肆虐的COVID-19?我国成功研制出mRNA疫苗了吗?今天我们一起了解mRNA疫苗的前世今生。
mRNA疫苗中的mRNA是什么?
mRNA(Messenger RNA),即信使RNA,是由DNA的一条链作为模板转录而来的,携带遗传信息的能指导蛋白质合成的一类单链RNA。通俗来讲,mRNA复制了细胞核中双链DNA的一条链的遗传信息,随即离开细胞核在细胞质中生成蛋白质。在细胞质中,核糖体沿着mRNA移动,读取其碱基序列,并翻译成其相应的氨基酸,最终形成蛋白质(图1)。
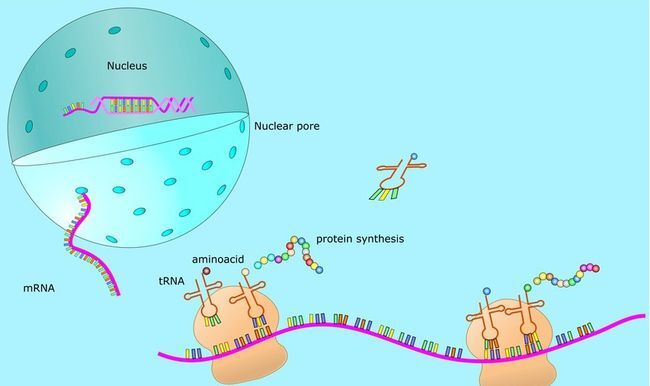
图1 mRNA工作过程(图源网络)
mRNA疫苗是什么,有何独特之处?
mRNA疫苗是将编码疾病特异性抗原的mRNA引入体内,利用宿主细胞的蛋白质合成机制产生抗原,从而触发免疫应答。
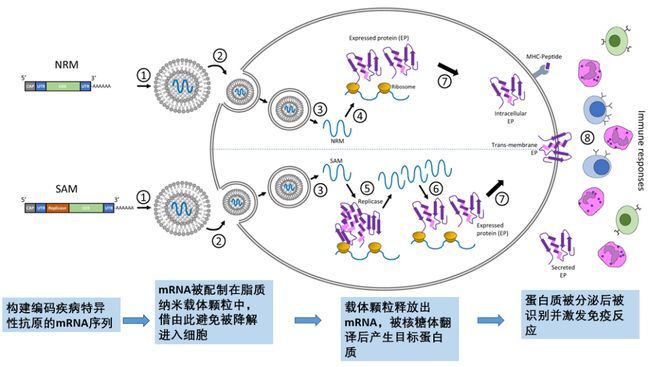
通常可根据不同疾病构建特异性抗原的mRNA序列,由新型脂质纳米载体颗粒包裹运送至细胞内,再利用人体核糖体翻译mRNA序列产生疾病的抗原蛋白,分泌后被自身免疫系统识别产生免疫反应,从而达到预防疾病作用(图2)。
图2 mRNA疫苗在体内作用(图源网络)
那么,与传统疫苗相比,这类mRNA疫苗又有什么独特之处呢?mRNA疫苗属于最为前沿的第三代疫苗,还有待于发展增强其稳定性、调节其免疫原性、发展新的传递技术等研究。
第一代传统疫苗主要包括灭活疫苗和减毒活疫苗,使用最为广泛。灭活疫苗是指先对病毒或细菌进行培养,然后用加热或化学剂(通常是福尔马林)将其灭活;减毒活疫苗是指病原体经过各种处理后,发生变异,毒性减弱,但仍保留其免疫原性。将其接种到身体内,不会引起疾病的发生,但病原体可在机体内生长繁殖,引发机体免疫反应,起到获得长期或终生保护的作用。
第二代新型疫苗包括亚单位疫苗和重组蛋白疫苗。亚单位疫苗是将致病菌主要的保护性免疫原存在的组分制成的疫苗亚单位疫苗,即通过化学分解或有控制性的蛋白质水解方法,提取细菌、病毒的特殊蛋白质结构,筛选出的具有免疫活性的片段制成的疫苗;重组蛋白疫苗是在不同细胞表达体系中产生的抗原重组蛋白。
第三代前沿疫苗包括DNA疫苗和mRNA疫苗。就是将编码某种抗原蛋白的病毒基因片段(DNA 或RNA ) 直接导入动物体细胞内(疫苗注射到人体),并通过宿主细胞的蛋白质合成系统产生抗原蛋白,诱导宿主产生对该抗原蛋白的免疫应答,以达到预防和治疗疾病的目的。两者的区别在于DNA是先转录成mRNA再合成蛋白质,mRNA则直接合成。
mRNA疫苗的发现史及应用价值
提到mRNA疫苗就不得不说一位科研卓著的女科学家——Kati Kariko,她为如今mRNA疫苗的问世奠定了扎实的科研基础。
她在读书期间就对mRNA充满了研究兴趣,在四十多年科研生涯中,屡屡受挫,未申请到科研基金,没有稳定的科研职位,但是她一直坚守mRNA的研究。
Kati Kariko(图源:网络)
mRNA疫苗的问世有3个重要节点。
第一步,她成功通过细胞培养制造想要的mRNA分子,不过想让mRNA在体内发挥作用却遇到了难题:将mRNA注入老鼠体内后会被老鼠的免疫系统吞噬。随后她遇到了Weissman,他们通过tRNA中一种叫做假尿苷的分子使mRNA逃避免疫反应,发表了一系列高水平文章,但是人体防御系统看到mRNA就攻击摧毁这一瓶颈仍无法突破[1][2]。
第二步,2000年左右,Pieter Cullis教授研究脂质纳米技术LNP,以用于基因沉默应用的siRNA体内递送[3][4]。Weissman组织Kariko等人研究发现,LNP是体内mRNA的合适载体,并有可能成为传递编码治疗性蛋白的mRNA的有价值的工具,随后在对预防寨卡病毒、HIV和肿瘤等进行了验证[5][6][7][8]。
第三步,在2010年和2013年,Moderna公司和BioNTech公司相继从宾夕法尼亚大学获得了与mRNA合成有关的专利许可进行进一步开发,卡塔琳也在2013年成为BioNTech公司的高级副总裁,进一步研制mRNA疫苗。
如今mRNA疫苗已可用于传染病、肿瘤以及哮喘等方面,在COVID-19肆虐全球的情况下,mRNA疫苗可能作为排头兵发挥作用。
mRNA疫苗在COVID-19的应用前景
随着COVID-19的全球流行,各国倾力研究用于阻遏新冠流行的疫苗。mRNA疫苗在作为一种新型疫苗,在新冠疫情来临时发挥了排头兵的作用。很多顶级期刊报道了mRNA在SARS-CoV-2新冠病毒的作用(图3)。
图3 mRNA疫苗预防新冠病毒的报道(来自NCBI)
首先,有很多科学家报道了针对新冠病毒的mRNA疫苗(SARS-CoV-2 mRNA)在小鼠体内的研究。
比如:脂质纳米颗粒包裹-核苷修饰的mRNA(mRNA-LNP)疫苗,单剂注射可诱导很强的1型CD4+ T和CD8+ T细胞反应、长寿命的血浆和记忆B细胞反应以及强大且持续的中和抗体反应。这说明mRNA-LNP疫苗是对抗COVID-19的有希望的候选者[9][10]。
其次,有科学家对比了SARS-CoV-2 mRNA和传统疫苗的效果。与重组蛋白疫苗相比:
mRNA疫苗在生发中心响应、Tfh激活、中和抗体产生、特异性记忆B细胞、长寿命浆细胞(long-lived plasma cells)等都远远优于蛋白疫苗[11]。
接着,随着SARS-CoV-2 mRNA候选疫苗进入临床试验,人们关注到疫苗保护期较短的问题。
科学家开发了一种脂质包裹形式的核苷修饰mRNA疫苗,称为mRNA-RBD。单次注射即可产生强大的中和抗体和细胞应答,并可几乎完全保护新冠病毒感染的模型小鼠,且高水平中和抗体保持了至少6.5个月。这些数据表明,单剂量的mRNA-RBD可提供针对SARS-CoV-2攻击的长期保护[12]。
还有科学家致力于研发新型安全有效的抗COVID-19疫苗,如BNT162b疫苗。
可保护猕猴免受SARS-CoV-2侵害,保护下呼吸道免受病毒RNA的侵害,产生高效抗体,并且没有显示出疾病增强的迹象。目前两名候选人接受I期试验的评估,全球II / III期试验中进行评估也在进行中,距离应用指日可待[13]。
我国mRNA疫苗在世界的地位
目前,BioNTech、Moderna和CureVac并称为全球三大mRNA疗法引领者,其中,BioNTech和Moderna在此次新冠疫苗研发中均处于研发前列。Moderna一直专注于mRNA相关药物和疫苗的研发,新冠肺炎三期试验疫苗mRNA-1273就是该公司目前进展最快的项目。BioNTech也是全球领先的mRNA药物和疫苗研发企业,mRNA药物/疫苗共19个,其中7个进入临床阶段。CureVac一直专注于mRNA药物/疫苗的研发,全球首家建立符合GMP标准的RNA生产线的公司,主要关注肿瘤、感染性疾病和罕见病。
虽然我国在国际mRNA疫苗的研发大军上处于相对后来者,但是中国正在崛起,奋起直追。在2020年7月23日国际顶刊Cell上,我国报道了自主研发的首个针对COVID-19的耐高温mRNA疫苗[1]。
该疫苗称为ARCoV,具有强大保护作用,生产为液体制剂,可以在室温下保存至少1周。
该疫苗是由苏州艾博生物科技公司联合军事医学研究院、云南沃森生物共同研制的,2020年7月该疫苗处于1期临床试验中,如今已进入二期临床尾声,预计4月底可以拿到三期临床批文,随后将开启海外多中心临床试验,预计今年年底即将问世。
参考资料
1. K Karikó, Buckstein M , Ni H , et al. Suppression of RNA Recognition by Toll-like Receptors: The Impact of Nucleoside Modification and the Evolutionary Origin of RNA[J]. Immunity, 2005, 23(2):165-175.
2. K Karikó, Muramatsu H , Welsh F A , et al. Incorporation of Pseudouridine Into mRNA Yields Superior Nonimmunogenic Vector With Increased Translational Capacity and Biological Stability[J]. Molecular Therapy, 2008.
3. Chonn A , Cullis P R . Recent advances in liposome technologies and their applications for systemic gene delivery[J]. Advanced Drug Delivery Reviews, 1998, 30(1-3):73.
4. Kulkarni J A , Witzigmann D , Chen S , et al. Lipid Nanoparticle Technology for Clinical Translation of siRNA Therapeutics[J]. Accounts of Chemical Research, 2019, 52(9).
5. Kariko, Katalin, Madden, et al. Expression kinetics of nucleoside-modified mRNA delivered in lipid nanoparticles to mice by various routes[J]. Journal of Controlled Release Official Journal of the Controlled Release Society, 2015.
6. Zika virus protection by a single low-dose nucleoside-modified mRNA vaccination[J]. Nature, 2017, 543(7644):248-251.
7. Pardi N , Secreto A J , Shan X , et al. Administration of nucleoside-modified mRNA encoding broadly neutralizing antibody protects humanized mice from HIV-1 challenge[J]. Nature Communications, 2017, 8:14630.
8. Stadler C R , B?Hr-Mahmud H , Celik L , et al. Elimination of large tumors in mice by mRNA-encoded bispecific antibodies[J]. Nature Medicine, 2017.
9. NN Zhang, Li X F , Deng Y Q , et al. A Thermostable mRNA Vaccine against COVID-19[J]. Cell, 2020.
10. D Laczkó, Hogan M J , Toulmin S A , et al. A Single Immunization with Nucleoside-Modified mRNA Vaccines Elicits Strong Cellular and Humoral Immune Responses against SARS-CoV-2 in Mice - ScienceDirect[J]. 2020.
11. Lederer K , Castao D , Atria D G , et al. SARS-CoV-2 mRNA Vaccines Foster Potent Antigen-Specific Germinal Center Responses Associated with Neutralizing Antibody Generation[J]. Immunity, 2020, 53(6):1281-1295.e5.
12. Huang Q , Ji K , Tian S , et al. A single-dose mRNA vaccine provides a long-term protection for hACE2 transgenic mice from SARS-CoV-2[J]. Nature Communications.
13. Vogel A B , Kanevsky I , Ye C , et al. Immunogenic BNT162b vaccines protect rhesus macaques from SARS-CoV-2[J]. Nature, 2021:1-10.