急性髓系白血病(Acute myeloid leukemia, AML)是一种具有高度异质性的恶性血液病,其特征是患者骨髓和外周血中原始、幼稚髓性细胞出现异常增生。早期基因组学研究解决了AML的一些临床异质性,并揭示了特定的药物靶点,但目前AML的研究仍存在许多挑战,例如能否在基因组特征之外能进一步细化AML分类,来提高生物标志物识别和治疗分层。
长期以来,蛋白质组学一直被视为基因组学、转录组学等方法的补充技术,填补了癌症生物学、识别诊断和预测的生物标志物等方面的研究空缺。近年来,蛋白质组学技术的不断进步为细胞蛋白质组的深度定量分析开辟了道路,使得利用其阐明癌症的分子病理生理学、系统地定义与临床相关的蛋白质基因组疾病亚型和生物标志物成为可能。
近日,德国歌德大学与马克斯·普朗克研究所的研究团队合作在Cancer Cell发表了题为“The proteogenomic subtypes of acute myeloid leukemia”的研究性文章。研究团队开发了一个多维整合分析平台,并基于此确定了五种蛋白质组AML亚型,每一种都反映了跨越基因组边界的特定生物学特征。值得注意的是,研究团队发现有一种亚型(Mito-AML)仅在蛋白质组中捕获,其特征是线粒体蛋白高表达且预后较差,在强化诱导化疗的治疗中缓解率降低,总生存期缩短。总之,该研究证明通过识别具有特定临床和分子特征的蛋白质组AML亚型对AML患者进行分类,可以识别基于基因组学治疗的漏洞,并有助于识别致病机制和预测生物标志物。

文章发表在Cancer Cell上
主要研究内容
AML蛋白质组亚型及其生物学特性的鉴定
研究团队设计了一个包含蛋白质表达、基因表达以及突变信息和细胞遗传学图谱的整合分析平台,并对252例AML患者(发现队列177例;独立验证队列75例)进行了深入的蛋白质组定量分析。
为了描述发现队列中蛋白质组学层面的患者亚群特征,研究团队对其定量蛋白质组数据进行了无监督的分层聚类分析,共得到了六个不同的蛋白质组亚群(C1-C6)。其中C1和C2都具有高表达的线粒体蛋白和线粒体相关过程,因此对其进行合并分析(C-Mito)。
接下来,研究团队通过对所有患者进行基因集富集分析,再次确认了合并亚群的独特线粒体谱,并分析了5个亚群间富集通路的异同。为了更详细地了解被鉴定的蛋白质组AML亚型之间的蛋白质组差异,研究团队探索了转录因子和激酶的表达模式。结果显示,这些蛋白质在不同蛋白质组学亚型中的表达存在显著差异,揭示了AML亚型间存在特定的代谢模式。

图1. AML蛋白质组亚型及其生物学特性的鉴定。来源:Cancer Cell
蛋白质组AML亚型的临床和基因组属性
在确定了五种蛋白质组AML亚型及其特定的蛋白质特征后,研究团队探讨了它们的临床相关性。临床相关分析显示,已确定的5个蛋白质组AML亚型中,C-Mito、C5显示出显著的预后相关性。其中,C-Mito组患者的总生存期(OS)较短且具有独立且显著的生存表型;C5预后较好,表现出DNMT3A突变频率增强等特点,但与C-Mito相比缺乏独特的蛋白表达特征。同时,风险类别的多因素分析显示,C-Mito亚群的差异可作为一个不良的风险因素,独立影响OS。

图2. C-Mito亚群具有更差的预后。来源:Cancer Cell
Mito-AML亚型在独立患者队列中的验证
接下来,研究团队在75人的独立验证队列中进一步验证了上述研究结果。研究团队首先利用Super-SILAC技术分析了蛋白表达情况,并通过层次聚类分析将验证队列分为3个亚组,发现其中一个亚群富集了上述C-Mito亚群的特征。
为确认验证队列中的C-Mito亚群是否与发现队列中的C-Mito亚群相同,研究团队使用递归特征选择方法训练了一个预测模型。结果显示,在验证队列中通过无监督聚类和路径分析确定为C-Mito的15例患者中,有14例被预测模型分类为C-Mito。这一结果表明C-Mito具有独特的预测特征,也为诊断标志物panel的建立奠定了基础。

图3. Mito-AML亚型在独立患者队列中的验证。来源:Cancer Cell
Mito-AML亚型蛋白质组网络的构建
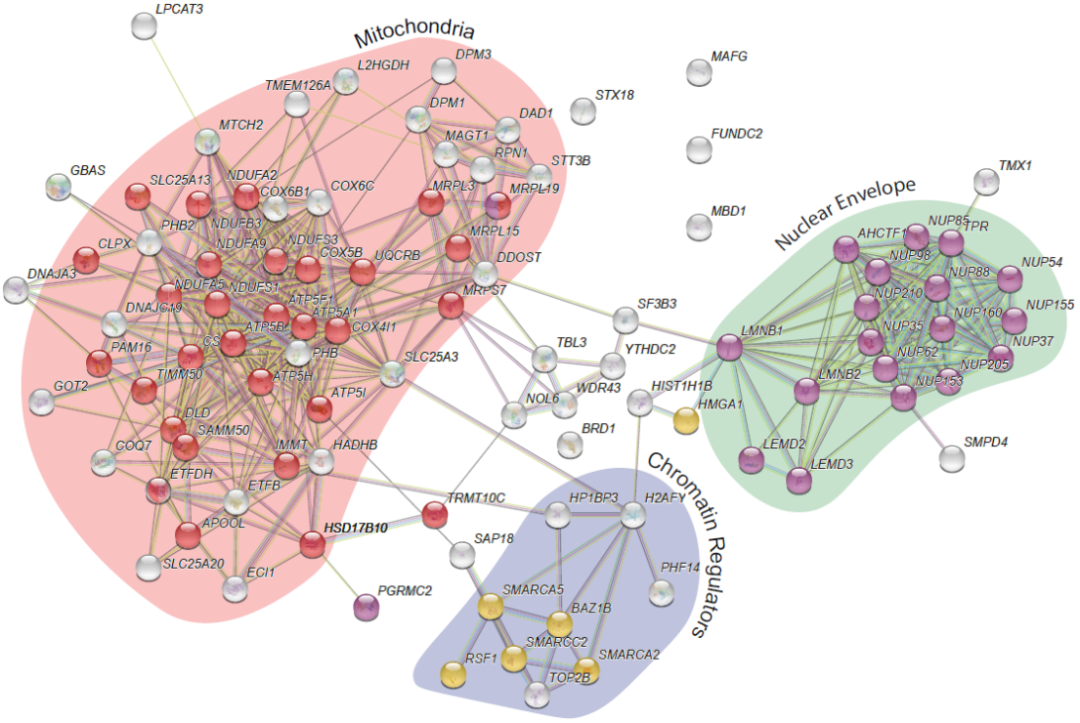
为进一步解析C-Mito的生物学特性,研究团队分析了C-Mito亚型中前100个与其他亚型想比存在显著表达差异的蛋白。分析显示,这些蛋白质大部分属于三种生物学分类:线粒体、核膜和染色质调节蛋白。通过结合先前发表的蛋白相互作用数据,研究团队揭示了这100个蛋白之间的强相互作用,并绘制了C-Mito亚群特征蛋白的相互作用网络。此外,在线粒体方面,研究团队发现C-Mito亚群中几乎所有线粒体蛋白都高表达,包括呼吸复合体I-V。上述研究结果揭示了导致C-Mito中线粒体蛋白积累的转录后潜在机制。
图4. Mito-AML亚型蛋白质组互作网络。来源:Cancer Cell
结语
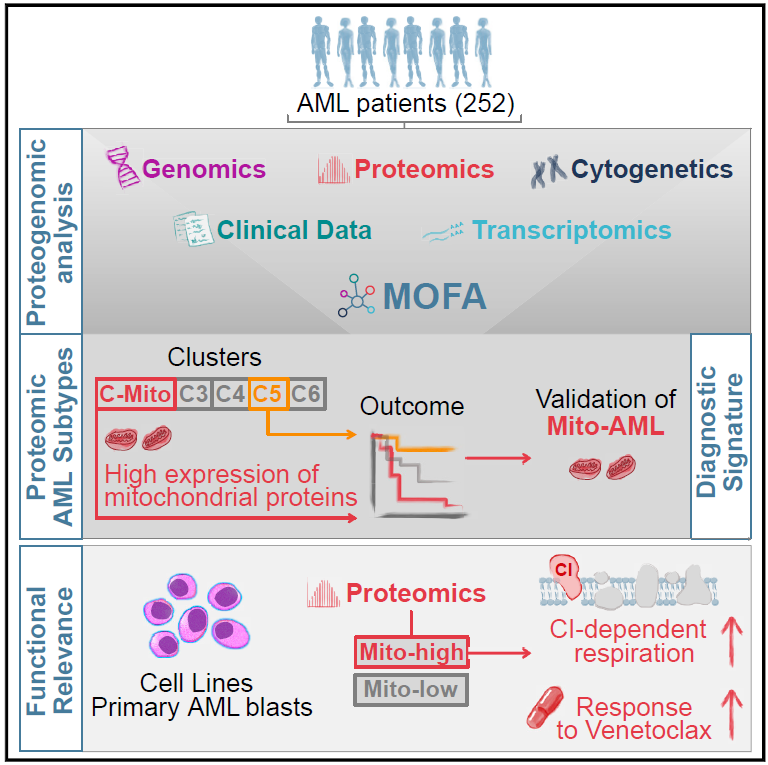
综上所述,该研究团队提供了AML的蛋白质组学研究框架,为AML的发病机制提供了新的见解,并基于特定的蛋白质表达模式鉴定了五个不同的蛋白质组亚群,发现了具有临床相关性的AML蛋白组亚型——Mito-AML ,确定了影响治疗反应和患者预后的分子特征。 此外,该研究的综合分析还揭示了AML蛋白质组与基因畸变之间的相互关系,并提出了可行 的治疗干预措施。
图5. 文章总结概图。来源:Cancer Cell
参考文献
1. Jayavelu et al., The proteogenomic subtypes of acute myeloid leukemia, Cancer Cell (2022).
2. Argelaguet, R., et al. (2018). Multi-Omics Factor Analysis—a framework for unsupervised integration of multi-omics datasets. Mol. Syst. Biol. 14.
3. Bhatt, S., et al. (2020). Reduced Mitochondrial Apoptotic Priming Drives Resistance to BH3 Mimetics in Acute Myeloid Leukemia (Cancer Cell).