近日,Halda Therapeutics宣布已经将新一代RIPTAC药物推进至人体临床阶段,2月24名第一例患者接受了药物注射,这也标志着首个RIPTAC进入临床试验。RIPTAC的概念和PROTAC概念类似,提出者都是Arvinas创始人耶鲁大学教授Craig Crews。RIPTAC算是某种形式上对于PROTAC不足之处的二次开发。
而现在Craig Crews带着新的概念和新的公司进入了正式实践。虽然形式类似,如果说PROTAC的核心目标是靶向蛋白质降解,那么RIPTAC的核心目标则是致力于实现。
RIPTAC技术简介
PROTAC能够同时结合靶蛋白和E3连接酶,形成三元复合物,从而诱导靶蛋白泛素化,进而被26S蛋白酶体识别并降解,但这一过程中,可能因为降解效率不足或靶蛋白突变导致耐药,这是有可能触发代偿机制而导致疗效不足。
相比于PROTAC,RIPTAC能够同时结合癌细胞中高表达的“靶蛋白”和维持细胞存活的“必需蛋白”。通过将两者锁定为复合体,RIPTAC可沉默必需蛋白功能,从而选择性地诱导癌细胞凋亡,同时减少对健康组织的影响。由于RIPTAC不依赖降解系统,通过功能抑制实现杀伤,可能克服因靶蛋白扩增导致的耐药问题。
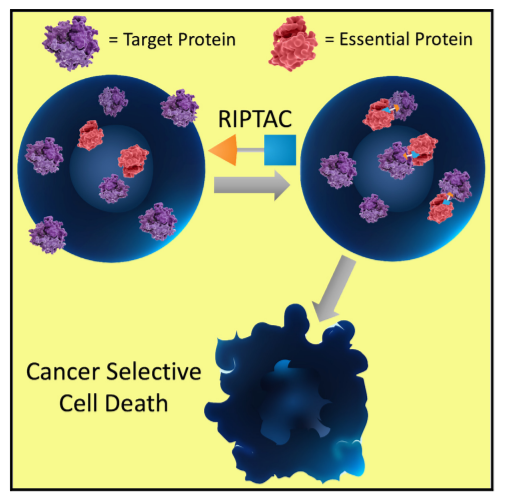
目前Halda的首创管线HLD-0915便是基于这一机理开发的,适应症为前列腺癌,靶向前列腺癌中高表达的AR和未公开的必需蛋白。另外该公司还有一款管线预计会在2026年申请激素受体阳性转移性乳腺癌的临床。
值得一提的是去年8月,Halda在资本寒冬中逆流而上,获得了1.26亿美元融资,专门用于开发上述两款产品临床。
能取代ADC吗?
一般而言,ADC仅能靶向癌细胞表面抗原,无法靶向癌细胞内的抗原,Craig Crews却推测异双功能小分子可靶向胞内目标。
2024年Craig Crews的团队在Cell Chemical Biology 发表了RIPTAC概念性验证论文。
在这项概念验证工作中,研究人员使用表达HaloTag-FKBP融合蛋白的细胞作为癌症标志物的替代品。他们的第一个RIPTACs由一个结合HaloTag-FKBP的配体、一个接头和一个基本蛋白如BRD4、CDK9或PLK1的配体组成。当他们用这些分子处理细胞时,他们发现RIPTACs选择性地杀死了HaloTag-FKBP标记的细胞,而且RIPTACs形成的三元复合体在细胞内呈现出累积状态。这或许是其能够作用于胞内的证明。
参考来源:
https://haldatx.com/halda-therapeutics-secures-126-million-financing-to-advance-riptac-cancer-therapies-into-the-clinic-for-major-solid-tumors/
https://www.cell.com/action/showPdf?pii=S2451-9456%2824%2900307-6
https://haldatx.com/wp-content/uploads/2023/04/Halda-AACR-Poster-20230417.pdf
doi: https://doi.org/10.1038/d41573-025-00037-7

